长期以来,肠道的器官稳态失衡被认为与个体衰老密切相关。肠上皮是成年哺乳动物中自我更新速度最快的组织,约4~5天更新一次。成年人的肠上皮由形成绒毛的分化细胞和隐窝中的干细胞组成。肠干细胞可以分化为不同的上皮细胞,从而形成有序的肠道结构,以维持肠道稳态和吸收、分泌、屏障与抗微生物功能等基本功能。然而,肠衰老的标志物和应答信号通路尚不清楚。
目前,研究认为线粒体功能障碍是细胞衰老的重要原因。有研究表明老年人类临床肠道样本存在线粒体DNA突变的积累。然而,随着年龄的增长,线粒体DNA突变累积是否以及如何调控肠衰老,仍是未知之谜。
近日,中国科学院广州生物医药与健康研究院刘兴国课题组在《自然-通讯》(Nature Communications)上发表研究成果,发现了老龄动物的肠中线粒体DNA低频点突变(0.005-0.05)的特异积累。研究团队利用动物模型和类器官技术论证线粒体DNA突变累积,导致肠道衰老过程中NADH/NAD+氧化还原态的消耗,并通过激活转录因子5(ATF5)依赖的线粒体未折叠蛋白反应(UPRmt)激活,损伤Wnt/β-catenin信号和耗竭肠干细胞以引发肠衰老,并进一步开发出通过补充NAD+前体NMN(烟酰胺单核苷酸)的逆转衰老方案。

该团队揭示了自然衰老动物的肠线粒体DNA突变随年龄变化的规律,并鉴定了类型为线粒体DNA低频点突变。为了解析线粒体DNA突变对肠衰老的因果作用,研究使用了线粒体DNA突变(线粒体DNA聚合酶γ-POLG突变)小鼠。研究通过POLG突变小鼠和野生型鼠产生了四类不同线粒体DNA突变率的小鼠。其中,POLG突变纯合子小鼠的线粒体DNA突变率最高,且和自然衰老小鼠一样,主要积累低频点突变。
研究结合肠类器官技术和肠干细胞内源标记技术发现,相同月龄下仅POLG突变纯合子小鼠更早出现了肠衰老的表型,展示出肠类器官分化程度低和肠干细胞数量锐减的现象,说明高负担的线粒体DNA突变可促进肠衰老的发生。这为肠衰老提供了线粒体DNA低频点突变这一新的生物标记。
该研究通过多组学分析和实验,聚焦到线粒体相关的通路。NADH/NAD+氧化还原态的消耗导致肠功能中发挥重要作用的Wnt/β-catenin信号衰减。进一步,研究通过NAD+前体NMN回补挽救了肠衰老表型,包括肠类器官分化和肠干细胞数量在一定程度上的恢复。研究发现,高负担的线粒体DNA突变导致NAD+缺失,激活了转录因子ATF5依赖的UPRmt这一全新通路,促进和加剧了肠衰老表型的发生。UPRmt被各种线粒体应激激活,包括线粒体与细胞核的蛋白失衡和线粒体蛋白运输障碍等。UPRmt的标志是LONP1、HSP60和ClpP蛋白表达增加。而线粒体DNA突变引发的衰老UPRmt激活中,仅有LONP1蛋白特异上调,为肠衰老提供了候选标志物。
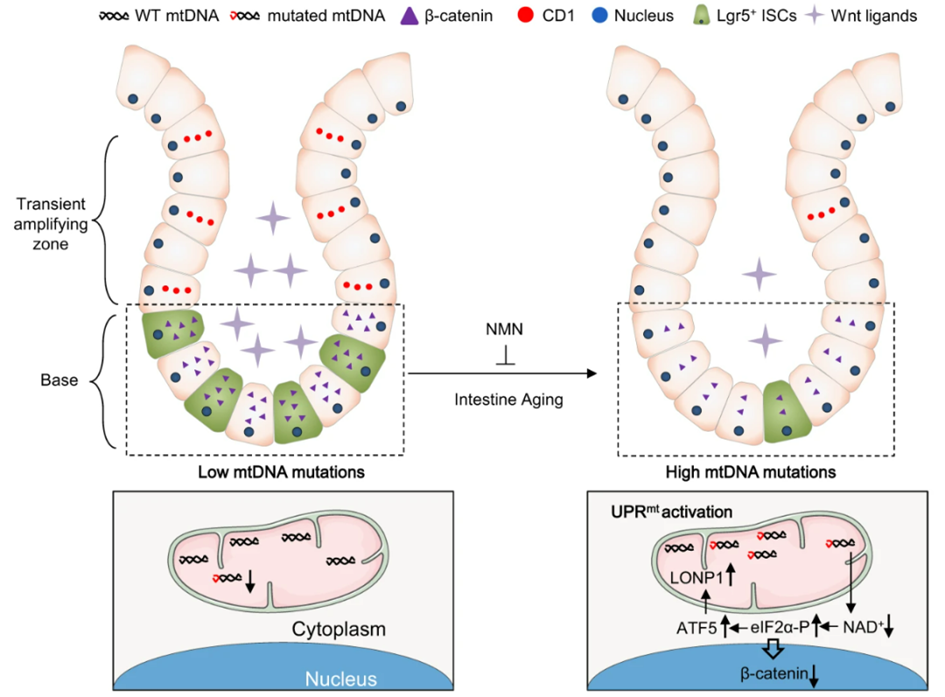
研究示意图(图片来源:原始论文[1])
综上,该研究首次解析了衰老累积的线粒体DNA突变与哺乳动物肠衰老之间因果关系的基本问题,鉴定了线粒体DNA低频点突变与LONP1 蛋白特异上调两个标志物,发现了从线粒体DNA突变,到线粒体反向信号、干细胞耗竭、细胞间信号,再到器官衰老的多层次时空机制,为延缓肠衰老提供了全新的思路、靶点和策略。
该研究由广州健康院、广州医科大学、中国科学院香港创新研究院(筹)、香港中文大学和新西兰奥克兰大学等合作完成。研究工作得到国家重点研发计划、中国科学院、国家自然科学基金、广东省和广州市的支持。
原始论文:[1] Yang, L., Ruan, Z., Lin, X. et al. NAD+ dependent UPRmt activation underlies intestinal aging caused by mitochondrial DNA mutations. Nat Commun 15, 546 (2024). https://doi.org/10.1038/s41467-024-44808-z













